BREVI APPUNTI DI CHIMICA
Il mondo che ci circonda è fatto di materia e energia. Materia è tutto ciò che occupa un volume ed è dotato di massa (dell'energia parleremo un'altra volta).
 |
Esistono tantissimi tipi di materie o sostanze chimiche. Quando al mattino vi sedete a fare colazione bevete il latte che è una sostanza chimica (o meglio un "miscuglio" di diverse sostanze chimiche), ma anche il vetro o la plastica della bottiglia che lo conteneva o il legno della sedia su cui sedete sono sostanze chimiche, così come i gas che formano l'atmosfera e che state respirando proprio in questo momento. In realtà anche voi siete formati da sostanze chimiche come ad esempio proteine, lipidi, glucidi, acidi nucleici.
Quindi fatevene una ragione, dalla chimica non si scappa! |
Come potete immaginare esistono migliaia di sostanze diverse, ma gli “ingredienti base” con cui si formano tutte queste sostanze non sono molti. In natura esistono poco più di novanta elementi. (ad esempio un essere umano è composto per il 99% da soli 4 elementi chimici: (idrogeno, ossigeno, carbonio e azoto).
Un ELEMENTO è una sostanza che non si può scomporre in sostanze più semplici. Ogni elemento è indicato da un simbolo composto da una o due lettere.
FATE MOLTA ATTENZIONE: se il simbolo di un elemento è costituito da una sola lettera, questa si scrive sempre in maiuscolo come O, K, S, H. Se il simbolo è costituito da due elementi la prima lettera si scrive sempre in maiuscolo e la seconda in minuscolo come Ca, Fe, Mg.
Ad esempio questa è la formula di un composto CO, il monossido di carbonio, formato da un atomo di carbonio e un atomo di ossigeno, se invece vedete Co siete sicuri che è il simbolo di un elemento (nel caso specifico il cobalto).
|
H = idrogeno |
Ca = calcio |
S = zolfo |
F = fluoro |
|
O = ossigeno |
K = potassio |
Fe = ferro |
Cl = cloro |
|
C = carbonio |
Na = sodio |
Ni = nichel |
Ag = argento |
|
N = azoto |
Mg = magnesio |
Br = bromo |
U = uranio |
|
P = fosforo |
He = elio |
Li = litio |
I = iodio |
|
He = elio |
Sr = stronzio |
Al = alluminio |
B = boro |
|
Au = oro |
Cu = rame |
Si = silicio |
Mn = manganese |
Ecco un elenco di alcuni dei più comini elementi
| Non sono molti gli elementi puri con cui entriamo in contatto ogni giorno, l'ossigeno e l'azoto che respiriamo sono appunto elementi e anche il diamante che avete regalato alla vostra fidanzata (o che vi hanno regalato) è formato da un solo elemento, il carbonio (se proprio volete fare i tirchi va bene anche un anellino d'oro). Il latte, la bottiglia e la sedia, così come l'acqua, il pane o il libro di scienze sono invece formati da composti, un insieme di molti elementi diversi legati tra loro. |

Il diamante è formato da carbonio puro, esttamente come la grafite che forma la mina di un lapis, la differenza sta solo nella struttura in cui si dipongono gli atomi. |
Un COMPOSTO è una sostanza formata dall'unione di due o più elementi diversi.
ATTENZIONE per avere un composto non basta semplicemente mescolare due (o più) elementi chimici, essi devono essere legati da un legame chimico e formare sostanze spesso molto dverse dagli elementi di partenza.
Ogni composto si può indicare con una formula chimica, in cui si riportano il simbolo degli elementi presenti e il numero di atomi che formano una molecola del composto in questione.
Ecco alcuni esempi esempi di come può essere rappresentato un composto:
|
Nome |
Metano |
Glucosio |
Cocaina |
|
Formula bruta |
CH4 |
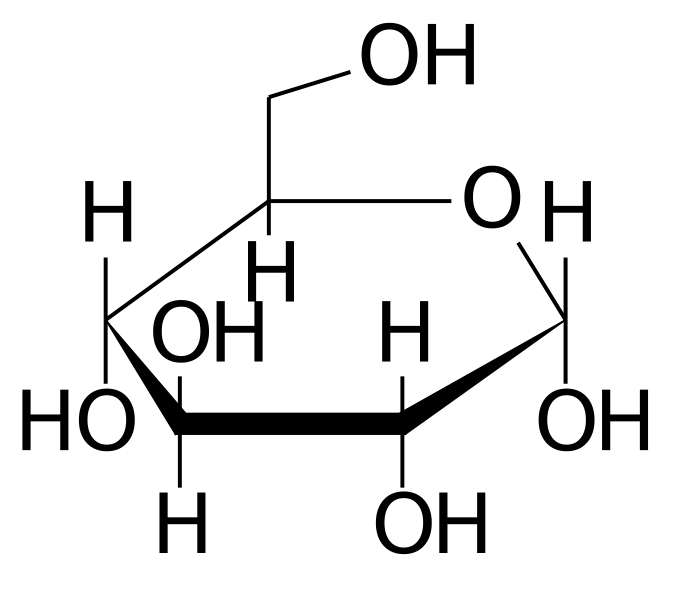
C6H12O6 |
C17H21NO4 |
|
Formula di struttura |

|
|
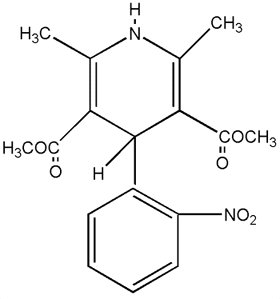
|
|
Modello tridimensionale |
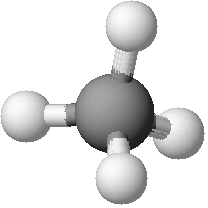
|
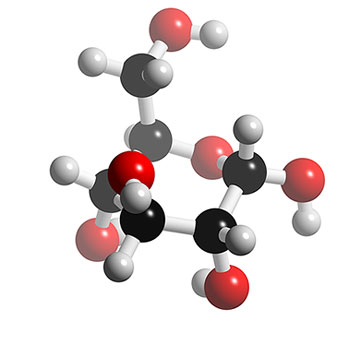
|
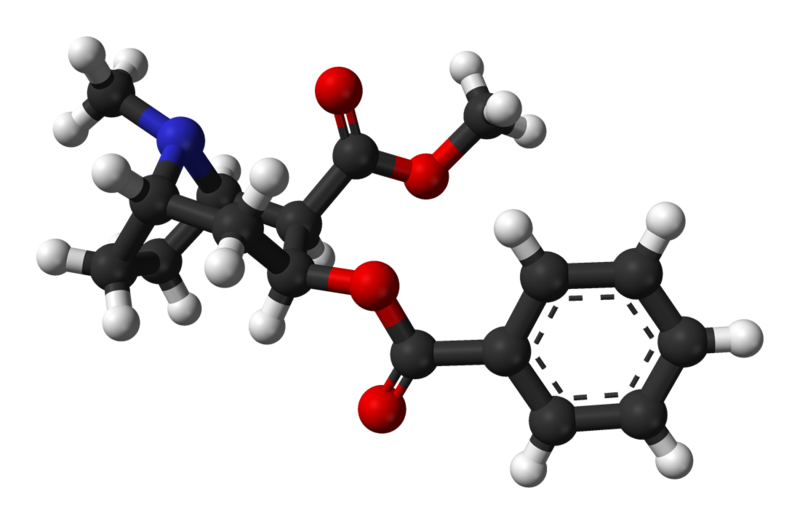
|
I composti sono formati da molecole, una MOLECOLA è un insieme di due o più atomi legati tra loro e può anche essere definita come la più piccola parte in cui si può suddividere un composto. Esistono però anche molecole formate da un solo elemento, ad esempio O2è una molecola formata da due atomi di ossigeno legati tra loro.
COME SI LEGGE UNA FORMULA CHIMICA?
La formula di un composto è costituita dai simboli degli elementi che lo compongono, ciascuno corredato da un indice (il numerino in basso a destra) che rappresenta il numero di atomi. Per esempio: H2O, la formula dell'acqua, indica che la sua molecola è formata da 2 atomi di idrogeno e da 1 atomo di ossigeno (il numero 1 non si scrive mai come indice); la formula dell'acido solforico, H2SO4, indica che la sua molecola è costituita da 2 atomi d'idrogeno, 1 atomo di zolfo, e 4 atomi di ossigeno.
Volendosi complicare la vita, si possono inserire nelle formule delle parentesi come ad esempio Fe2(SO4)3 in questo caso si ragiona come in una formula matematica. Tutto quello che si trova tra parentesi viene ripetuto per il numero di volte indicato dall'indice accanto alla parentesi. Nel nostro caso una molecola di solfato di ferro sarà formata da 2 atomi di Ferro (Fe) 1x3=3 atomi di zolfo (S) e 4x3=12 atomi di ossigeno, totale 17 atomi.
Un ATOMO invece è la più piccola parte in cui si può suddividere un elemento e che mantiene le proprietà dell'elemento stesso.
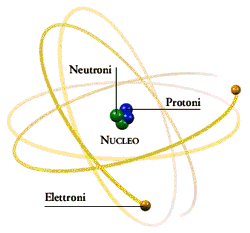
Atomo di elio |
Ogni atomo è composto da particelle più piccole che sono: protoni, neutroni e elettroni. Nella figura qui a lato è rappresentato un atomo di elio che comprende due protoni, due neutroni e due elettroni.
Gli elettroni hanno carica elettrica negativa, i protoni hanno carica elettrica positiva, mentre i neutroni hanno carica elettrica uguale a zero. Normalmente un atomo possiede lo stesso numero di protoni neutroni ed elettroni e quindi la sua carica elettrica totale è pari a zero (ad esempio l'elio possiede due neutroni: carica=0, due protoni: carica +2, due elettroni: carica -2, totale0+2-2=0)
Riassumendo: |
| Particella |
Massa |
Carica elettrica |
| Protone |
1 uma |
+ |
| Neutrone |
1 uma |
0 |
| Elettrone |
0 |
- |
(Per "pesare" gli atomi non si usano Kg o grammi, ma una apposita unità di misura detta uma -unità di massa atomica-. Una uma per definizione corrsiponde ad un dodicesimo della massa del carbonio 12, cioè in pratica corrisponde alla massa di un protone)
IONI E ISOTOPI
Un atomo non cambia mai il numero di protoni, semplicemente perché anche se lo facesse diventerebbe semplicemente un altro elemento. Se ad esempio un atomo di carbonio che ha 6 protoni, ne acquistasse un altro diventerebbe un atomo di azoto, anzi possiamo dire che la sola differenza tra l'azoto e il carbonio sta appunto nel numero di protoni presenti nel nucleo. Il NUMERO ATOMICO, cioè il numero di protoni presenti nel nucleo di un atomo è la sua carta d'identità.
Se un atomo però perde o guadagna degli elettroni acquista una carica elettrica, questi atomi vengono definiti ioni.
Uno ione è un atomo che ha la stessa massa di un atomo normale, ma la sua carica elettrica totale non è più uguale a 0. In particolare se un atomo perde elettroni le cariche positive dei protoni nel nucleo non saranno più esattamente bilanciate e l'atomo diventerà positivo (ad esempio Na+, la carica si segna in alto a destra accanto al simbolo dell'elemento. Gli ioni con carica positiva vengono definiti cationi. Se invece l'atomo acquista elettroni la sua carica elettrica totale diventerà negativa (ad esempio Cl-). Uno ione con carica negativa si definisce anione.
Quando invece gli atomi perdono o acquistano dei neutroni la loro carica elettrica rimane invariata, ma la loro massa cambia, si formano in questo modo degli isotopi, cioè atomi con un anomalo numero di neutroni. Questi atomi sono solitamente radioattivi perché tendono a espellere dal loro nucleo i neutroni in eccesso.
Alcuni isotopi come il carbonio 14 (14C, il numero di massa si indica in alto a sinistra), non sono pericolosi, anzi ciascuno di noi ne possiede una certa percentuale all'interno del corpo, mentre altri come gli isotopi dell'uranio e del plutonio con cui si alimentano le centrali nucleari sono estremamante pericolosi e mortali per ogni forma di vita.
Ricodate sempre che protoni, neutroni e elettroni sono uguali per tutti gli atomi, l'unica differenza tra un elemento e un altro sta nel numero di protoni presenti.










